Что такое кс в химии. Химическое равновесие: константа химического равновесия и способы ее выражения
Многие химические реакции являются обратимыми, т.е. могут одновременно протекать в обоих направлениях – прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Ещё одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне
Химически обратимые реакции первоначально протекают в одном направлении за счет взаимодействия между собой исходных веществ. По мере накопления продуктов реакции они начинают взаимодействовать между собой с образованием исходных веществ.
Рассмотрим обратимую реакцию, в которой порядок реакции по каждому из веществ совпадает со стехиометрическими коэффициентами.
а (A) + b (B) = c (C) + d (D)
Графическая зависимость скоростей прямой (V 1) и обратной (V 2) реакций обратимого химического процесса от времени
В результате в системе устанавливается химическое равновесие, и концентрации исходных и конечных веществ перестают изменяться. Неизменность концентраций веществ во времени может наблюдаться также в случае очень медленно протекающих реакций. Но такое состояние не является истинным химическим равновесием. Признаки истинного химического равновесия :
1. состояние системы остается неизменным во времени при отсутствии внешних воздействий;
2. состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были;
3. состояние системы не зависит от того, с какой стороны она подходит к равновесию.
Положение химического равновесия – это достигнутое при равновесии соотношение концентраций реагирующих веществ, которое неизменно для данного состояния. Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P.
Состояние химического равновесия описывается законом действующих масс .
При достижении равновесия отношение произведения концентраций (парциальных давлений) продуктов реакции в степенях, соответствующих стехиометрическим коэффициентам, к произведению концентраций исходных веществ также в степенях, соответствующих стехиометрическим коэффициентам, представляет собой константу . Она зависит только от природы реагирующих веществ и температуры. Константа, выраженная через равновесные концентрации C i обозначается K с, а выраженная через парциальные давления P i – K р.
Для гомогенного процесса
а (А) + b (В) = d (D) + k (K)
K
с =  или K
р =
или K
р =  .
.
Для гетерогенного процесса
а (А) + b (В) = с [C] + d (D)
K
с =  или K
р =
или K
р =  .
.
Концентрация вещества С в процессе взаимодействия не изменяется, поэтому не включается в выражение константы равновесия (С не является действующей массой).
Выражение для К с и К р представляет собой математическое выражение закона действующих масс применительно к обратимым процессам.
Используя уравнение Менделеева-Клапейрона РV= (m / M) RT, преобразование которого
дает связь между К с и К р:
К р = К с (RT) D n ,
Dn разность между количеством образовавшихся газообразных продуктов и количеством исходных газообразных веществ.
По значению константы химического равновесия можно судить о глубине протекания процесса к моменту достижения равновесия.
В расчетах, связанных с использованием констант равновесия K с , в предлагаемых задачах используются понятия равновесные и исходные концентрации, изменения концентраций. Равновесными называют концентрации реагирующих веществ в состоянии химического равновесия (С ), исходными считают заданные до начала реакции концентрации веществ (С 0). Равновесные концентрации реагентов (С ) связаны с их исходной концентрацией (С 0) уравнением С = С 0 – DС , где DС – количество исходного вещества которое прореагировало до наступления состояния равновесия.
Пример 1 . Равновесие реакции 2(NO) + (O 2) = 2(NO 2) установилось при следующих концентрациях реагирующих веществ: C NO = 0,02 моль/л; С О = 0,01 моль/л; С NO = 0,01 моль/л. Вычислить константу равновесия и исходные концентрации NO и О 2 .
Решение . Для расчета константы химического равновесия подставим значения равновесных концентраций всех реагирующих веществ в выражение K с :
K с
=  =
=  = 0,25.
= 0,25.
Найдем исходные концентрации NO и O 2 по соотношению С 0 = С + DС . Для определения исходных концентраций каждого из веществ нужно вычислить значения DС . Из уравнения реакции видим, что из 2 молей NO в результате реакции образуется 2 моля NО 2 , следовательно, на образование 0,01 моля NО 2 к моменту установления равновесия расходовалось 0,01 моля NО. Равновесная концентрация NO составляет 0,02 моль/л, значит, C 0(NO) = 0,02 + 0,01 = 0,03 моль/л. Рассуждая аналогично, получим значение DС О = 0,005 моль/л, так как по уравнению реакции 1 моль О 2 расходуется при образовании 2 молей NО 2 . C 0(О ) = 0,01 + 0,005 = 0,015 моль/л.
Пример 2 . Исходные концентрации оксида углерода (IV) и водорода равны соответственно 6 моль/л и 4 моль/л. Константа равновесия процесса (СО 2) + (Н 2) = (СО) + (Н 2 О) равна 0,5. Вычислить равновесные концентрации всех веществ.
Решение
K с
=  .
.
Обозначим DС СО , концентрацию прореагировавшего СО 2 к моменту равновесия за х . Тогда С СО = 6 – х . С 1 молем СО 2 взаимодействует 1 моль Н 2 , поэтому количество прореагировавшего водорода в реакции также будет х, С Н = 4 – х .
Из уравнения реакции следует, что из 1 моля СО 2 образуется 1 моль СО, а из 1 моля водорода – 1 моль Н 2 О, следовательно, концентрации образовавшихся веществ будут равны по х (моль/л).
Подставив значения равновесных концентраций в выражение константы, решим его относительно х :
0,5 =  , откуда х
= 2 моль/л.
, откуда х
= 2 моль/л.
Значит, количество прореагировавших СО 2 и Н 2 и образовавшихся СО и Н 2 О составляет 2 моль/л.
Равновесные концентрации СО 2 и Н 2 соответственно равны:
6 – 2 = 4 моль/л и 4 – 2 = 2 моль/л.
Пример 3 . Исходная концентрация вещества А в системе (А) = 2(В) составляет 2 моль/л. Равновесие установилось, когда прореагировало 20%исходного вещества. Вычислить константу равновесия процесса.
Решение . Запишем выражение константы равновесия:
K с = .
Вычислим значения равновесных концентраций веществ А и В. Из условия задачи следует, что количество прореагировавшего вещества А составляет 20%от исходного количества, т. е. DС А = = 0,2 × 2 = 0,4 моль/л. Равновесная концентрация вещества А определяется как разность С 0(А) – DС А = 2 – 0,4 = 1,6 моль/л. Из 1 моля А образуется 2 моля В. Следовательно, если к моменту установления равновесия расходовано 0,4 моль/л вещества А, то образовалось 0,8 моль/л вещества В. Тогда С В = 0,8 моль/л.
Подставим значения равновесных концентраций в выражение константы равновесия и получим величину константы:
K с = = 1,6.
ЭНТРОПИЯ
Возможность самопроизвольного протекания химического процесса определяется двумя факторами: стремлением системы к понижению внутренней энергии за счет экзотермической реакции (-DH ) и стремлением системы к увеличению неупорядоченности в расположении частиц за счет теплового движения. При низких температурах преобладает стремление к минимуму энергии. При высоких температурах за счет усиления хаотического движения частиц вещества главную роль начинает играть фактор повышения неупорядоченности, мерой которой является функция состояния, называемая энтропией.
Энтропия (S) - термодинамическая функция, однозначно характеризующая состояние системы независимо от ее предыстории. Она является количественной мерой неупорядоченности системы, мерой хаотического движения и взаимного расположения частиц. Энтропия зависит от природы вещества, его количества (концентрации), давления и температуры. В отличие от внутренней энергии и энтальпии можно определить абсолютное значение энтропии.
В изолированных системах (где обмен с окружающей средой энергией и массой невозможен) процессы самопроизвольно протекают лишь в сторону повышения энтропии (второе начало термодинамики ). Т.е. в изолированных системах изменение энтропии может использоваться для определения направления самопроизвольного протекания процесса.
Энтропия вещества в определенном состоянии (при заданных параметрах) в определенном агрегатном состоянии (газ, жидкость, твердое) пропорциональна логарифму термодинамической вероятности нахождения вещества в этом состоянии (уравнение Больцмана):
S = k ln W,
Где k = R / N A , W – термодинамическая вероятность состояния, которая определяется числом микросостояний, с помощью которых может быть реализовано данное макросостояние.
В идеальном кристалле при абсолютном нуле Т=0К, движение прекращается, положение частиц остается неизменным, и вероятность состояния системы может быть только одна. Следовательно, энтропия идеального кристалла при абсолютном нуле S=0.
Третье начало термодинамики гласит, что энтропия беспримесного идеального кристаллического тела при температуре 0 К равна нулю.
Стандартной считается энтропия, отнесенная к 1 молю вещества при стандартных условиях (давление 1 атм (101,32 кПа) и температура 298 К (25 О С)). Значения стандартных энтропий для большинства химических соединений представлены в справочной литературе. Единицей измерения энтропии, как правило, является Джоуль на моль-кельвин (Дж /(моль К)).
Константа равновесия
Конста́нта равнове́сия - величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями , концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Способы выражения константы равновесия
Например, для реакции окисления монооксида углерода :
2CO + O 2 = 2CO 2
константа равновесия может быть рассчитана по уравнению:
где Δn - изменение числа молей веществ в ходе реакции. Видно, что K x зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ (), то .
Стандартная константа равновесия
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии = 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
где - относительные парциальные давления компонентов, .Стандартная константа равновесия - безразмерная величина. Она связана с K p соотношением:
Видно, что если выражены в атмосферах, то и .
Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям = 0,1013 МПа или 1 атм. K f связана с K 0 соотношением:
где γ i - коэффициент фугитивности i-го реального газа в смеси.Константа равновесия реакций в гетерогенных системах
FeO т + CO г = Fe т + CO 2гконстанта равновесия (при условии, что газовая фаза идеальна) имеет вид:
Константа равновесия и изменение энергии Гиббса
Константа равновесия и константа скорости реакции
Для обратимой химической реакции константа равновесия может быть выражена через константы скорости прямых и обратных реакций, исходя из того факта, что в состоянии равновесия скорости прямой и обратной реакций равны. Например, для элементарной обратимой химической реакции первого порядка
где k 1 - константа скорости прямой реакции, а k 2 - обратной. Это важное соотношение даёт одну из «точек соприкосновения» химической кинетики и химической термодинамики.Методы расчета константы равновесия
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG 0 ), а затем использованию формулы:
, где - универсальная газовая постоянная .При этом следует помнить, что энергия Гиббса - функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG 0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG 0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию (см. Закон Гесса). В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
Энтропийный метод расчёта ΔG реакции является одним из самых распространённых и удобных . Он основан на соотношении:
или, соответственно, для стандартного изменения энергии Гиббса:
Здесь ΔH 0 при постоянных давлении и температуре равно тепловому эффекту реакции, методы расчёта и экспериментального определения которого известны - см., например, уравнение Кирхгофа :
Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
- По термическим данным - с опорой на тепловую теорему Нернста и с использованием сведений о температурной зависимости теплоёмкости участников реакции. Например, для веществ, при нормальных условиях находящихся в твёрдом состоянии:
Итак, если извеcтны , и температурные зависимости теплоёмкости, может быть рассчитано по формуле:
Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
И еще более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
Переход от к константе равновесия осуществляется по приведённой выше формуле.
Расчёт константы равновесия методами статистической термодинамики
| Этот раздел статьи ещё не написан. |
К С = [С] р [D] q ? [А] m [В] n , (4.24)
где [С], [D], [А], [В] - равновесные концентрации.
В обратимых химических реакциях равновесие устанавливается в тот момент, когда отношение произведения концентраций продуктов, возведенных в степени, равные стехиометрическим коэффициентам, к произведению концентраций исходных веществ, также возведенных в соответствующие степени, равно некоторой постоянной величине, называемой константой химического равновесия.
В выражение константы равновесия, как и в выражение скорости реакции, не входят концентрации веществ, образующих конденсированные фазы или присутствующих в большом избытке. Например, для реакции:
Fe 3 O 4 (т) + 4Н 2 (г) 3Fe (т) + 4Н 2 О (г) (4.25)
К С = [Н 2 О] 4 / [Н 2 ] 4 , (4.26)
где, - равновесные парциальные давления газообразных веществ.
К Р = К С (RT) Дн, (4.28)
где Дн - изменение числа молей газообразных веществ.
Энергия Гиббса химической реакции связана с константой равновесия
КР = exp(-ДG0/ RT), (4.29)
ДG 0 = -2,3RTlg К Р, (4.30)
ДG = -2,3RTlg К С. (4.31)
ДG 0 = -5,71·lg К Р. (4.32)
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Изменение внешних условий (концентрации, температуры, давления) вызывает смещение химического равновесия в системе и переход ее в новое равновесное состояние.
Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, производить какое-либо внешнее воздействие (изменять концентрацию, температуру, давление), то в этой системе самопроизвольно возникают процессы, стремящиеся ослабить произведенное воздействие.
Принцип Ле Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций (парциальных давлений) одного или нескольких веществ должно приводить к такому изменению равновесных концентраций (парциальных давлений) других веществ, чтобы соблюдалось постоянство константы равновесия.
- 1. Влияние концентраций (парциальных давлений) компонентов системы. При увеличении концентрации одного из компонентов равновесие системы нарушается. При этом ускорится реакция его расходования. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации всех компонентов будут такими, чтобы соотношение между ними, определяемое константой равновесия, оставалось постоянным.
- 2. Влияние общего давления в системе. Если в результате реакции изменяется число молей газообразных веществ, то изменение общего давления в системе вызывает смещение равновесия. В соответствии с принципом Ле Шателье увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления.
- 3. Влияние температуры. С увеличением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций, протекание которых обеспечивает поглощение теплоты.
химический реакция тепло нейтрализация
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X = 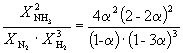 и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 = , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Константа химического равновесия - характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Константа химического равновесия определяется по закону действующих масс . Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
Константа равновесия и энергия Гиббса
Константа равновесия ~K связана со свободной энергией Гиббса ~\Delta G следующим образом:
~\Delta G=-RT\cdot\ln K.Приведенное уравнение позволяет по величине ΔG° вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов.
Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры (если выразить отсюда константу, то температура будет в показателе степени). Для эндотермических процессов повышение температуры отвечает увеличению константы равновесия, для экзотермических - ее уменьшению. От давления константа равновесия не зависит, кроме случаев очень большого давления (от 100 Па).
Зависимость константы равновесия от энтальпийного и энтропийного факторов свидетельствует о влиянии на нее природы реагентов.
Константа равновесия и скорость реакции
Можно выразить константу равновесия через скорость реакции. При этом константа равновесия определяется как
~K=\frac{k_1}{k_{-1}},где ~k_1 - константа скорости прямой реакции, ~k_{-1} - константа скорости обратной реакции.